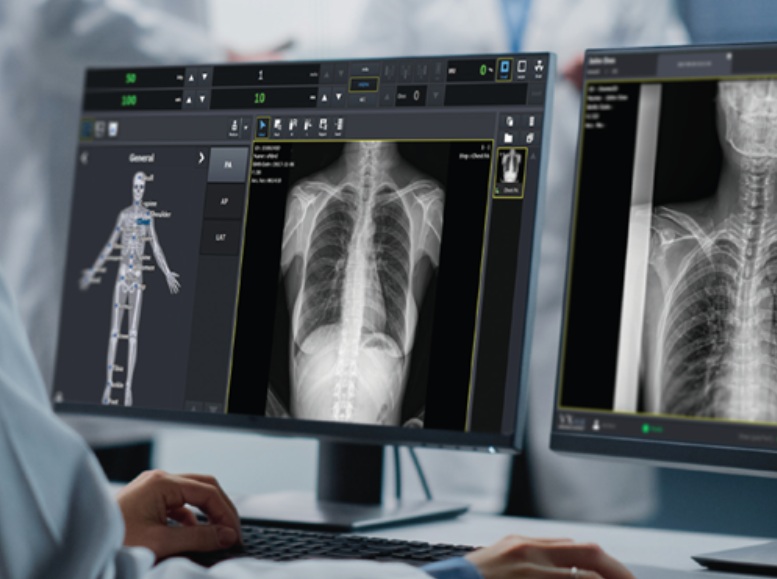
의료 및 산업용 영상 솔루션 전문기업 뷰웍스(대표 김후식)는 자사의 디지털 의료영상 획득 및 처리 소프트웨어 ‘브이엑스뷰’(VXvue)가 미국 식품의약청(FDA)으로부터 시판 전 허가(510K) 승인을 획득했다고 12일 밝혔다. 이번 승인으로 뷰웍스는 북미 시장에 엑스레이 디텍터 및 전용 소프트웨어가 결합된 시스템을 일체형으로 공급할 수 있게 됐다.
뷰웍스는 AI 기반 영상처리 알고리즘을 포함한 소프트웨어로 FDA 승인을 획득했다. 특히 강화된 심사 기준에 맞춰 시판 의료기기와의 동등성, 품질관리 절차, 사후관리 체계를 입증했다.
자체 개발된 브이엑스뷰는 엑스레이 디텍터를 통해 획득한 임상 이미지를 송출·처리하는 사용자 중심 소프트웨어다. ‘퓨어임팩트’(PureImpact™) 알고리즘을 탑재해 영상 선명도를 높이고, 인체 연조직과 골격의 세부 묘사를 향상시킨다. 또한 인체용, 수의용, 이동검진 등 진료 환경별로 세분화된 프리셋을 제공해 사용자 편의성을 강화했다.
뷰웍스는 이번 FDA 승인을 비롯해 유럽 CE 인증 등 글로벌 인증을 지속적으로 확보하며 기술 경쟁력을 강화하고 있다. 지난해 장형 디텍터 ‘VIVIX-S 1751S’와 유방촬영용 ‘VIVIX-M 1824S’, ‘VIVIX-M 2430S’가 FDA 승인을 받았으며, 올해 5월에는 슬라이드 스캐너 ‘VISQUE DPS LH510’이 유럽 체외진단의료기기 인증 ‘CE IVDR’을 획득했다.
뷰웍스 관계자는 “이번 FDA 승인을 통해 하드웨어와 소프트웨어 양 측면에서 글로벌 기술력을 입증했다”며, “저선량 촬영, 효율적 데이터 관리, 협진 환경 강화 등 의료 현장의 요구에 부합하는 고부가가치 솔루션을 지속적으로 개발하겠다”고 밝혔다.
- 관련 기사 더 보기
Vieworks' VXView Receives FDA Approval

Vieworks (CEO Husik Kim), a medical and industrial imaging solutions specialist, announced on the 12th that its digital medical image acquisition and processing software, VXvue, has received premarket clearance (510K) from the U.S. Food and Drug Administration (FDA). With this approval, Vieworks can now supply an integrated system combining an X-ray detector and dedicated software to the North American market.
Vieworks has received FDA approval for its software, which includes an AI-based image processing algorithm. Specifically, it demonstrated equivalence with commercially available medical devices, quality control procedures, and a post-management system, all in compliance with strengthened review standards.
Our proprietary VXView is a user-centric software solution that transmits and processes clinical images acquired through an X-ray detector. Equipped with the "PureImpact™" algorithm, it enhances image clarity and enhances the detail of human soft tissue and skeletal structures. Furthermore, it offers presets tailored to specific clinical environments, including human, veterinary, and mobile examinations, enhancing user convenience.
Vieworks is strengthening its technological competitiveness by continuously securing global certifications, including this FDA approval and European CE certification. Last year, the long-type detector "VIVIX-S 1751S" and the mammography devices "VIVIX-M 1824S" and "VIVIX-M 2430S" received FDA approval. In May of this year, the slide scanner "VISQUE DPS LH510" received European in vitro diagnostic medical device certification "CE IVDR."
A Vieworks representative stated, “With this FDA approval, we have proven our global technological prowess in both hardware and software,” and added, “We will continue to develop high value-added solutions that meet the needs of the medical field, such as low-dose imaging, efficient data management, and strengthening the collaborative environment.”
- See more related articles
ビューワークス「VXビュー」が米国FDA承認を獲得

医療および産業用映像ソリューション専門企業ビューワークス(代表キム・フシク)は、同社のデジタル医療映像獲得および処理ソフトウェア「VXvue」が米国食品医薬庁(FDA)から市販前許可(510K)承認を獲得したと12日明らかにした。今回の承認により、ビューワークスは北米市場にX線ディテクタと専用ソフトウェアが結合されたシステムを一体型で供給できるようになった。
ビューワークスはAIベースの映像処理アルゴリズムを含むソフトウェアでFDA承認を獲得した。特に強化された審査基準に合わせて市販医療機器との同等性、品質管理手続き、事後管理体系を立証した。
自社開発されたVXビューはX線ディテクタを通じて獲得した臨床イメージを送出・処理するユーザー中心ソフトウェアだ。 「ピュアインパクト」(PureImpact™)アルゴリズムを搭載して映像の鮮明度を高め、人体軟組織と骨格の細部描写を向上させる。また、人体用、獣医用、移動検診など診療環境別に細分化されたプリセットを提供し、ユーザーの利便性を強化した。
ビューワークスは今回のFDA承認をはじめ、欧州CE認証などグローバル認証を継続的に確保し、技術競争力を強化している。昨年、長形ディテクター「VIVIX-S 1751S」と乳房撮影用「VIVIX-M 1824S」、「VIVIX-M 2430S」がFDA承認を受け、今年5月にはスライドスキャナー「VISQUE DPS LH510」が欧州体外陣の。
ビューワークス関係者は「今回のFDA承認を通じてハードウェアとソフトウェアの両面でグローバルな技術力を立証した」とし、「低線量撮影、効率的なデータ管理、協調環境の強化など、医療現場の要求に合致する高付加価値ソリューションを継続的に開発する」と明らかにした。
- 関連記事をもっと見る
Vieworks公司的VXView获得FDA批准

医疗和工业成像解决方案专家Vieworks(首席执行官 Husik Kim)于 12 日宣布,其数字医疗图像采集和处理软件 VXvue 已获得美国食品药品监督管理局 (FDA) 的上市前许可 (510K)。获得此项批准后,Vieworks 现在可以向北美市场提供集成了 X 射线探测器和专用软件的系统。
Vieworks的软件已获得FDA批准,该软件包含基于人工智能的图像处理算法。具体而言,该公司证明其产品与市售医疗器械具有同等效力,并具备完善的质量控制流程和完善的售后管理系统,所有这些都符合更严格的审查标准。
我们自主研发的VXView是一款以用户为中心的软件解决方案,用于传输和处理通过X射线探测器采集的临床图像。它配备了“PureImpact™”算法,可增强图像清晰度,并提升人体软组织和骨骼结构的细节表现。此外,它还提供针对特定临床环境(包括人体、兽医和移动检查)的预设模式,从而提升用户便捷性。
Vieworks 通过不断获得全球认证,包括此次的 FDA 批准和欧洲 CE 认证,持续提升其技术竞争力。去年,长型探测器“VIVIX-S 1751S”以及乳腺 X 光机“VIVIX-M 1824S”和“VIVIX-M 2430S”获得了 FDA 批准。今年 5 月,幻灯片扫描仪“VISQUE DPS LH510”获得了欧洲体外诊断医疗器械认证“CE IVDR”。
Vieworks 的一位代表表示:“凭借此次 FDA 的批准,我们证明了我们在硬件和软件方面的全球技术实力。”他补充道:“我们将继续开发满足医疗领域需求的高附加值解决方案,例如低剂量成像、高效数据管理和加强协作环境。”
- 查看更多相关文章
Le système VXView de Vieworks reçoit l'approbation de la FDA

Vieworks (PDG : Husik Kim), spécialiste des solutions d’imagerie médicale et industrielle, a annoncé le 12 que son logiciel d’acquisition et de traitement d’images médicales numériques, VXvue, a reçu l’autorisation de mise sur le marché (510(k)) de la FDA (Food and Drug Administration) américaine. Grâce à cette approbation, Vieworks peut désormais proposer sur le marché nord-américain un système intégré combinant un détecteur de rayons X et un logiciel dédié.
Vieworks a obtenu l'approbation de la FDA pour son logiciel, qui intègre un algorithme de traitement d'images basé sur l'IA. Plus précisément, l'entreprise a démontré son équivalence avec les dispositifs médicaux disponibles sur le marché, ses procédures de contrôle qualité et son système de suivi, le tout conformément aux normes d'évaluation renforcées.
Notre solution logicielle exclusive VXView, intuitive et conviviale, permet la transmission et le traitement d'images cliniques acquises par un détecteur à rayons X. Grâce à l'algorithme « PureImpact™ », elle améliore la netteté et la précision des détails des tissus mous et du squelette humains. De plus, elle propose des préréglages adaptés à différents contextes cliniques (examens humains, vétérinaires et mobiles), pour un confort d'utilisation optimal.
Vieworks renforce sa compétitivité technologique en obtenant régulièrement des certifications internationales, notamment l'approbation de la FDA et la certification CE européenne. L'année dernière, le détecteur long « VIVIX-S 1751S » et les mammographes « VIVIX-M 1824S » et « VIVIX-M 2430S » ont reçu l'approbation de la FDA. En mai dernier, le scanner de lames « VISQUE DPS LH510 » a obtenu la certification européenne « CE IVDR » pour les dispositifs médicaux de diagnostic in vitro.
Un représentant de Vieworks a déclaré : « Grâce à cette approbation de la FDA, nous avons prouvé notre savoir-faire technologique mondial, tant au niveau du matériel que des logiciels », et a ajouté : « Nous continuerons à développer des solutions à forte valeur ajoutée qui répondent aux besoins du secteur médical, comme l'imagerie à faible dose, la gestion efficace des données et le renforcement de l'environnement collaboratif. »
- Voir plus d'articles connexes
You must be logged in to post a comment.