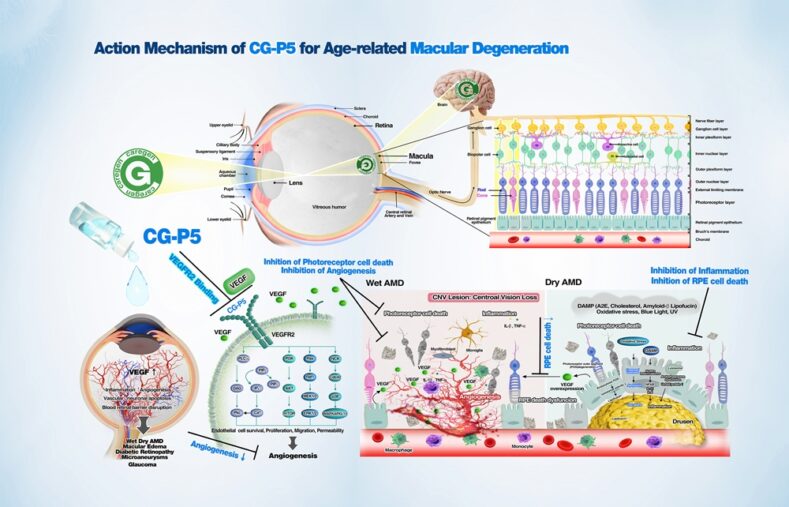
생명공학기업 케어젠(대표 정용지)은 오는 3일부터 6일까지 인도 뉴델리에서 열리는 아시아태평양안과학회(APAO : Asia Pacific Academy of Ophthalmology) 2025 에서 혁신적인 습성 황반변성 치료제 ‘CG-P5’ 를 공개한다. 이번 학회는 케어젠이 안과 분야에서 처음으로 참여하는 국제 학회로, 글로벌 안과 전문의와 제약사들이 대거 참석하는 권위 있는 행사다.
케어젠은 이번 APAO 2025에서 CG-P5의 작용 기전, 임상 진행 현황 등을 소개하며, 글로벌 안과 시장에서의 기술리더십과 입지 강화를 목표로 한다. CG-P5는 생체 활성 펩타이드를 기반으로 한 점안 치료제로, 기존의 항혈관내피세포성장인자(Anti-VEGF) 주사 치료제(예: 아일리아, 루센티스 등)와 달리 눈에 직접 주사하지 않고 점안으로 투여할 수 있어 환자의 편의성과 순응도를 획기적으로 개선할 것으로 기대된다.
현재 CG-P5는 미국 FDA 임상 1상 마무리 단계에 있으며, 아일리아(Eylea)를 대조군으로 한 비교 임상이 진행 중이다. 해당 임상은 2025년 6월경 종료 예정으로, 이후 혁신 신약 지정(BTD, Breakthrough Therapy Designation) 신청을 준비 중이다. 또한 건성 황반변성 등 적응증 확대를 통해 임상 2상 진입도 계획하고 있다.
이 같은 진전을 바탕으로 다수의 글로벌 안과 전문 제약사들과의 기술 이전 협의가 활발히 이어지고 있으며, 특히 중국과 인도를 비롯한 주요 국가 제약사들과의 협의가 상당히 진척되고 있다. 케어젠은 APAO 2025를 기점으로 본격적인 글로벌 파트너십 체결이 가시화될 것으로 내다보고 있다.
케어젠 정용지 대표는 “CG-P5는 기존 치료 방식의 한계를 뛰어넘는 혁신적인 펩타이드 기반 점안 치료제로, APAO 2025에서 글로벌 제약사들과의 전략적 협력을 강화하고 시장 진출을 가속화할 것”이라며, “지속적으로 이어지는 기술 이전 제안은 CG-P5의 높은 시장성과 기술적 우수성을 입증하는 사례”라고 강조했다.
한편, 케어젠은 습성 황반변성 치료제 외에도 안구건조증 치료제 ‘CG-T1’ 개발에도 역량을 집중하고 있다. CG-T1은 기존 사이클로스포린(Cyclosporine) 제제와는 달리 PAC1 수용체를 타겟으로 하는 펩타이드 기반 약물로, 점안시 안구 자극을 최소화하면서 효과적으로 염증을 억제할 수 있어 보다 근본적이며 빠른 치료 효과가 기대된다. 케어젠은 2025년 하반기 미국 FDA에 임상 1상 진입을 위한 임상시험계획(IND)신청을 준비 중이다.
케어젠은 이번 APAO 2025에서 CG-P5및 CG-T1의 작용 기전과 연구 데이터를 공개하고, 세계 각국의 안과 전문가 및 연구진과의 협력 네트워크를 강화할 계획이다. 또한 APAO를 시작으로, 유럽망막학회(EURETINA) 등 주요 국제 안과 학회 및 전시회에 지속적으로 참가하여 글로벌 안과 시장에서의 존재감과 영향력을 점차 확장해 나갈 방침이다.
- 관련 기사 더 보기
Caregen participates in 'Asia Pacific Ophthalmology Society 2025'

Caregen, a biotechnology company (CEO Yongji Jeong), will unveil its innovative wet macular degeneration treatment 'CG-P5' at the Asia Pacific Academy of Ophthalmology (APAO) 2025, which will be held in New Delhi, India from the 3rd to the 6th. This conference is the first international conference that Caregen is participating in in the field of ophthalmology, and is a prestigious event attended by many global ophthalmologists and pharmaceutical companies.
At APAO 2025, Caregen aims to introduce the mechanism of action and clinical progress of CG-P5 and strengthen its technological leadership and position in the global ophthalmology market. CG-P5 is an eye drop treatment based on a bioactive peptide. Unlike existing anti-VEGF injection treatments (e.g., Eylea, Lucentis, etc.), it can be administered as eye drops rather than directly injected into the eye, which is expected to dramatically improve patient convenience and compliance.
Currently, CG-P5 is in the final stages of the US FDA phase 1 clinical trial, and a comparative clinical trial using Eylea as a control group is in progress. The clinical trial is scheduled to end around June 2025, and an application for Breakthrough Therapy Designation (BTD) is being prepared thereafter. In addition, plans are being made to enter phase 2 clinical trials by expanding indications such as dry macular degeneration.
Based on this progress, active technology transfer discussions are ongoing with a number of global ophthalmology pharmaceutical companies, and in particular, discussions with pharmaceutical companies in major countries including China and India are progressing considerably. Caregen expects that full-scale global partnerships will become visible starting with APAO 2025.
Caregen CEO Yong-ji Jeong emphasized, “CG-P5 is an innovative peptide-based eye drop treatment that overcomes the limitations of existing treatments. We will strengthen strategic cooperation with global pharmaceutical companies and accelerate our market entry at APAO 2025.” He also added, “The ongoing technology transfer proposals are examples that prove the high marketability and technological excellence of CG-P5.”
Meanwhile, Caregen is also focusing its capabilities on developing 'CG-T1', a dry eye treatment, in addition to the wet macular degeneration treatment. Unlike existing cyclosporine preparations, CG-T1 is a peptide-based drug that targets the PAC1 receptor, and is expected to have a more fundamental and rapid treatment effect as it can effectively suppress inflammation while minimizing eye irritation when instilled. Caregen is preparing to apply for an investigational new drug (IND) to the US FDA for phase 1 clinical trials in the second half of 2025.
Caregen plans to disclose the action mechanisms and research data of CG-P5 and CG-T1 at APAO 2025 and strengthen its collaborative network with ophthalmology experts and researchers from around the world. In addition, starting with APAO, the company plans to continuously participate in major international ophthalmology conferences and exhibitions, such as the European Society of Retina (EURETINA), to gradually expand its presence and influence in the global ophthalmology market.
- See more related articles
ケアゼン、「アジア太平洋眼科学会2025」参加

バイオテクノロジー企業ケアゼン(代表チョン・ヨンジ)は来る3日から6日までインドニューデリーで開かれるアジア太平洋眼科学会(APAO:Asia Pacific Academy of Ophthalmology)2025で革新的な湿性黄斑変性治療剤「CG-P5」を公開する。今回の学会はケアゼンが眼科分野で初めて参加する国際学会で、グローバル眼科専門医や製薬会社が大挙参加する権威ある行事だ。
ケアゼンは今回のAPAO 2025でCG-P5の作用機序、臨床進行状況などを紹介し、グローバル眼科市場における技術リーダーシップと立地強化を目指す。 CG-P5は生物活性ペプチドをベースとした点眼治療剤であり、既存の抗血管内皮細胞成長因子(Anti-VEGF)注射治療剤(例えば、アイリア、ルセンティスなど)とは異なり、目に直接注射せずに点眼で投与することができ、患者の利便性とコンプライアンスを画期的に改善するものと期待される。
現在、CG-P5は米国FDA臨床1相の仕上げ段階にあり、アイリア(Eylea)を対照群とした比較臨床が進行中である。当該臨床は2025年6月頃終了予定で、以後イノベーション新薬指定(BTD, Breakthrough Therapy Designation)申請を準備中だ。また、乾性黄斑変性など適応症の拡大を通じて臨床二相進入も計画している。
このような進展に基づいて、多数のグローバル眼科専門製薬会社との技術移転協議が活発に続いており、特に中国やインドをはじめとする主要国家製薬会社との協議がかなり進んでいる。ケアゼンはAPAO 2025を起点に本格的なグローバルパートナーシップ締結が可視化されると見通している。
ケアゼンジョンヨンジ代表は「CG-P5は既存の治療方式の限界を超える革新的なペプチドベースの点眼治療剤で、APAO 2025でグローバル製薬会社との戦略的協力を強化し、市場進出を加速するだろう」とし、「継続的に続く技術移転提案はCG-P5の高い市場性と技術。
一方、ケアゼンは湿性黄斑変性治療剤の他に、眼球乾燥症治療剤「CG-T1」の開発にも力量を集中している。 CG-T1は、従来のシクロスポリン製剤とは異なり、PAC1受容体をターゲットとするペプチドベースの薬物であり、点眼時の眼刺激を最小限に抑えながら効果的に炎症を抑制することができ、より根本的かつ迅速な治療効果が期待される。ケアゼンは2025年下半期、米国FDAに臨床1相進入のための臨床試験計画(IND)申請を準備中だ。
ケアゼンは今回のAPAO 2025でCG-P5およびCG-T1の作用機序と研究データを公開し、世界各国の眼科専門家および研究陣との協力ネットワークを強化する計画だ。またAPAOをはじめ、欧州網膜学会(EURETINA)など主要国際眼科学会および展示会に継続的に参加し、グローバル眼科市場における存在感と影響力を徐々に拡大していく方針だ。
- 関連記事をもっと見る
Caregen 参加“2025 年亚太眼科学会”

生物技术公司Caregen(代表:郑永吉)将于3日至6日在印度新德里举办的2025年亚太眼科学会(APAO)上推出其创新型湿性黄斑变性治疗药物“CG-P5”。此次会议是Caregen首次参加的眼科领域国际会议,是全球众多眼科医生和药企出席的盛会。
在APAO 2025上,Caregen将介绍CG-P5的作用机制和临床进展,旨在加强其在全球眼科市场的技术领导地位和地位。 CG-P5 是一种基于生物活性肽的眼药水治疗方法。与现有的抗 VEGF 注射治疗(例如 Eylea、Lucentis 等)不同,它可以作为眼药水给药,而不是直接注射到眼睛中,预计将大幅提高患者的便利性和依从性。
目前,CG-P5正与美国FDA进行1期临床试验的最后阶段,并以Eylea作为对照组的对比临床试验正在进行中。该临床试验预计于 2025 年 6 月左右结束,之后正在准备突破性治疗指定 (BTD) 的申请。此外,我们计划通过扩大适应症,包括干性黄斑变性,进入第二阶段临床试验。
基于此进展,公司正在与多家全球眼科制药公司进行积极的技术转让洽谈,特别是与中国、印度等主要国家制药公司的洽谈正在取得重大进展。 Caregen 预计,从 APAO 2025 开始,全面的全球合作伙伴关系将会显现。
Caregen 首席执行官 Yong-ji Jeong 强调:“CG-P5 是一种创新的肽基滴眼液治疗方法,克服了现有治疗方法的局限性。我们将在 APAO 2025 上加强与全球制药公司的战略合作,加快进入市场。”他还补充道:“正在进行的技术转让提案就是CG-P5高市场性和技术卓越性的证明。”
同时,除了湿性黄斑变性治疗外,Caregen还致力于开发干眼症治疗药物“CG-T1”。与现有的环孢菌素制剂不同,CG-T1是一种针对PAC1受体的肽类药物,在应用于眼部时可有效抑制炎症,同时最大限度地减少眼部刺激,有望发挥更根本、更快速的治疗效果。 Caregen 准备向美国 FDA 提交新药临床试验 (IND) 申请,于 2025 年下半年进行第 1 阶段临床试验。
Caregen计划在APAO 2025上公开CG-P5和CG-T1的作用机制和研究数据,并加强与世界各地眼科专家和研究人员的合作网络。此外,我们计划以APAO为起点,通过持续参加欧洲视网膜学会(EURETINA)等大型国际眼科会议和展会,逐步扩大我们在全球眼科市场的存在和影响力。
- 查看更多相关文章
Caregen participe à la conférence « Asia Pacific Ophthalmology Society 2025 »

Caregen, une société de biotechnologie (PDG Yongji Jeong), dévoilera son traitement innovant contre la dégénérescence maculaire humide « CG-P5 » à l'Asia Pacific Academy of Ophthalmology (APAO) 2025, qui se tiendra à New Delhi, en Inde, du 3 au 6. Cette conférence est la première conférence internationale dans le domaine de l'ophtalmologie à laquelle Caregen participe et constitue un événement prestigieux auquel participent de nombreux ophtalmologistes et sociétés pharmaceutiques du monde entier.
Lors de l'APAO 2025, Caregen présentera le mécanisme d'action et les progrès cliniques du CG-P5, et vise à renforcer son leadership technologique et sa position sur le marché mondial de l'ophtalmologie. CG-P5 est un traitement par gouttes ophtalmiques à base d'un peptide bioactif. Contrairement aux traitements par injection anti-VEGF existants (par exemple, Eylea, Lucentis, etc.), il peut être administré sous forme de gouttes ophtalmiques plutôt que directement injecté dans l'œil, et devrait améliorer considérablement la commodité et l'observance du traitement pour le patient.
Actuellement, le CG-P5 est dans les dernières étapes des essais cliniques de phase 1 avec la FDA américaine, et un essai clinique comparatif utilisant Eylea comme groupe témoin est en cours. L'essai clinique devrait se terminer vers juin 2025, après quoi une demande de désignation de thérapie révolutionnaire (BTD) est en cours de préparation. De plus, nous prévoyons d’entrer dans des essais cliniques de phase 2 en élargissant les indications, y compris la dégénérescence maculaire sèche.
Sur la base de ces progrès, des discussions actives sur le transfert de technologie sont en cours avec un certain nombre de sociétés pharmaceutiques mondiales spécialisées en ophtalmologie, et en particulier, les discussions avec des sociétés pharmaceutiques de grands pays, dont la Chine et l’Inde, progressent de manière significative. Caregen prévoit que des partenariats mondiaux à grande échelle deviendront visibles à partir de l'APAO 2025.
Yong-ji Jeong, PDG de Caregen, a souligné : « Le CG-P5 est un collyre innovant à base de peptides qui surmonte les limites des traitements existants. Nous renforcerons notre coopération stratégique avec les laboratoires pharmaceutiques mondiaux et accélérerons notre entrée sur le marché lors du salon APAO 2025. » Il a également ajouté : « Les propositions de transfert de technologie en cours sont des exemples qui prouvent la grande valeur marchande et l’excellence technologique du CG-P5. »
Parallèlement, Caregen concentre également ses capacités sur le développement du « CG-T1 », un traitement contre la sécheresse oculaire, en plus du traitement de la dégénérescence maculaire humide. Contrairement aux préparations de cyclosporine existantes, le CG-T1 est un médicament à base de peptides qui cible le récepteur PAC1 et devrait avoir un effet thérapeutique plus fondamental et plus rapide car il peut supprimer efficacement l'inflammation tout en minimisant l'irritation oculaire lorsqu'il est appliqué sur l'œil. Caregen se prépare à soumettre une demande de nouveau médicament expérimental (IND) à la FDA américaine pour des essais cliniques de phase 1 au cours du second semestre 2025.
Caregen prévoit de divulguer le mécanisme d'action et les données de recherche de CG-P5 et CG-T1 à l'APAO 2025 et de renforcer son réseau de collaboration avec des experts et des chercheurs en ophtalmologie du monde entier. De plus, en commençant par l'APAO, nous prévoyons d'étendre progressivement notre présence et notre influence sur le marché mondial de l'ophtalmologie en participant en permanence aux principales conférences et expositions internationales d'ophtalmologie, telles que la Société européenne de la rétine (EURETINA).
- Voir plus d'articles connexes
You must be logged in to post a comment.