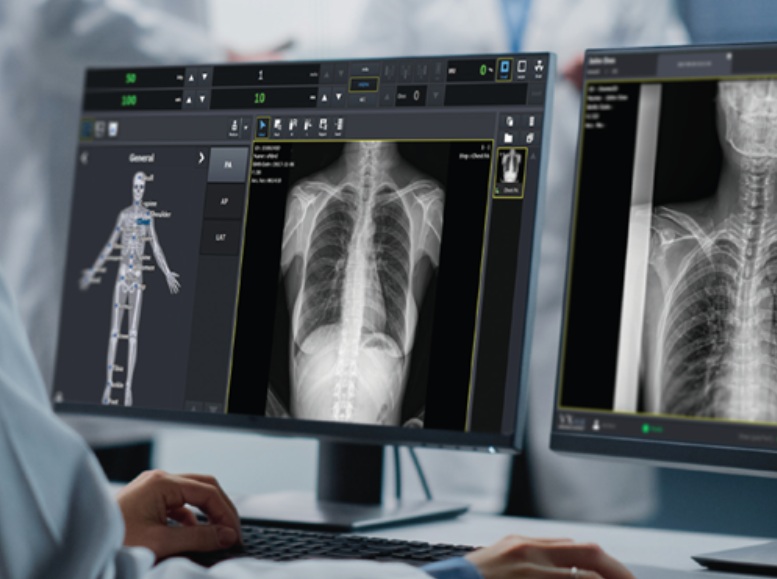
医療および産業用映像ソリューション専門企業ビューワークス(代表キム・フシク)は、同社のデジタル医療映像獲得および処理ソフトウェア「VXvue」が米国食品医薬庁(FDA)から市販前許可(510K)承認を獲得したと12日明らかにした。今回の承認により、ビューワークスは北米市場にX線ディテクタと専用ソフトウェアが結合されたシステムを一体型で供給できるようになった。
ビューワークスはAIベースの映像処理アルゴリズムを含むソフトウェアでFDA承認を獲得した。特に強化された審査基準に合わせて市販医療機器との同等性、品質管理手続き、事後管理体系を立証した。
自社開発されたVXビューはX線ディテクタを通じて獲得した臨床イメージを送出・処理するユーザー中心ソフトウェアだ。 「ピュアインパクト」(PureImpact™)アルゴリズムを搭載して映像の鮮明度を高め、人体軟組織と骨格の細部描写を向上させる。また、人体用、獣医用、移動検診など診療環境別に細分化されたプリセットを提供し、ユーザーの利便性を強化した。
ビューワークスは今回のFDA承認をはじめ、欧州CE認証などグローバル認証を継続的に確保し、技術競争力を強化している。昨年、長形ディテクター「VIVIX-S 1751S」と乳房撮影用「VIVIX-M 1824S」、「VIVIX-M 2430S」がFDA承認を受け、今年5月にはスライドスキャナー「VISQUE DPS LH510」が欧州体外陣の。
ビューワークス関係者は「今回のFDA承認を通じてハードウェアとソフトウェアの両面でグローバルな技術力を立証した」とし、「低線量撮影、効率的なデータ管理、協調環境の強化など、医療現場の要求に合致する高付加価値ソリューションを継続的に開発する」と明らかにした。
- 関連記事をもっと見る
You must be logged in to post a comment.